Une protéine: tentative de vulgarisation à l'intention des foldingueurs
Nous, les foldingueurs, nous plions des protéines. Et nous le faisons bien. Mais qu'est qu'une protéine au juste ?
C'est suite à cette légitime interrogation qu'après des mois de retard j'ai décidé d'écrire un petit texte vulgarisateur certes mais jamais vulgaire sur ces merveilleuses petites choses.
Les protéines sont les constituants essentiels de toute cellules vivantes, responsable de sa structure, de se fonctionnalité.
C'est le composant le plus important quantitativement et fonctionnement au niveau de la cellule, les autres composants étant les lipides, les glucides, et les acides nucléiques.
Il faut savoir qu'une protéine est un ensemble d'organisation supérieur dont la base est l'acide aminé.
Ces acides aminés (AA) sont les briques de la vie, témoin d'une vie organique (on peut d'ailleurs considérer les acides aminés comme un ensemble d'organisation supérieur dont la base sont les atomes -carbone, hydrogène, oxygène, souffre...-)
La découverte d'acides aminés dans certains météorites martiens est le témoin d'une vie organique ( = basé sur un squelette de carbone).
La structure primaire est la simple énumération de la séquence d'acides aminés composant la protéine, de gauche (extrémité dite N-terminale) à droite (extrémité C-terminale).
Cette séquence est pleinement définie par l'ADN de la cellule. En fait l'ADN ne contient qu'une information : l'ensemble de toutes les séquences primaires des protéines qui sont potentiellement synthétisable par la cellule.
Outre la séquence d'acides aminés, la structure primaire contient d'autres informations :
La durée de vie de la protéine : elle est défini par la nature du premier acide aminé de la séquence :
Nature du premier acide aminé Demi vie de la protéine Isoleucine 2 minutes Asparagine 10 minutes Arginine 30 minutes Méthionine Supérieure à 24h Les séquences consensus : La combinaison successif de plusieurs acides aminés dans la séquence peuvent avoir une signification très précise : La combinaison Asparagine-X-Sérine et Asparagine-X-thréonine (ou X est un AA indifférent) veut dire qu'un motif de sucre peut se fixer sur la protéine à cet endroit précis. Ces combinaisons sont très nombreuses, et touchent beaucoup de domaine, comme l'emplacement de la protéine dans la cellule. On parle alors de motif d'adressage codé au sein même de la structure primaire de la protéine. Ces séquences consensus peuvent être séparés par des acides aminés indifférents ou bien encore se recouvrir partiellement.
Remarque:
Les acides aminés peuvent être ionisés (porteurs d'une charge), en fonction du milieu. La nature de la charge et le nombre de charge dépend donc à la fois du type d'acides aminés et du mileu (basique, neutre, acide). Ces charges vont interagir entre eux et vont contribuer à replier la protéine créant ainsi la structure secondaire et tertiaire de la protéine.
La séquence primaire de la protéine de collagène de bœuf et humaine est extrêmement proche. Cependant Elle sera tout de même reconnu comme non-soi par le système humanitaire et sera détruite par un système de dégradation des protéines de la cellule (que nous détaillerons).
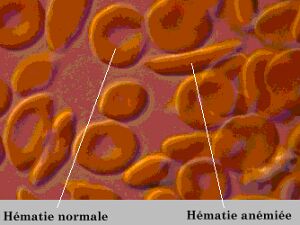
Le remplacement d'un seul acides aminés (glutamate) par un autre (valine) dans la séquence de l'hémoglobine modifie les propriétés fonctionnelles de cette protéine : cette hémoglobine anormale cristallise en cas de manque d'oxygène et déforme les globules rouges (hématies) qui prennent la forme de faucille : c'est l'anémie falciforme, ou drépanocytose.
La structure secondaire est un premier niveau de repliement de la protéine.
Il est du à deux facteurs :
L'établissement de liaisons hydrogène entre des acidés aminés VOISINS dans la séquence
Définition:la liaison hydrogène
La liaison hydrogène est une liaison électrostatique qui se crée quand un atome d'hydrogène (pole positif) lié a un atome avec un pole négatif (oxygène par exemple) est à proximité d'un autre atome avec un pole négatif.
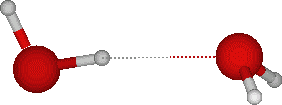 Ansi ici nous avons deux molécules d'eau: en rouge l'oxygène, lié aux deux hydrogènes (H2O). L'hydrogène d'une molécule crée donc une liaison hydrogène avec l'atome d'oxygène d'une autre molécule d'eau. Il faut noter que le nombre de liaison hydrogène est directement corrélé avec l'état de l'eau: 0 à l'état gazeux, 3.4 -en moyenne- à l'état liquide, 4 (le maximum) à l'état solide.
Ansi ici nous avons deux molécules d'eau: en rouge l'oxygène, lié aux deux hydrogènes (H2O). L'hydrogène d'une molécule crée donc une liaison hydrogène avec l'atome d'oxygène d'une autre molécule d'eau. Il faut noter que le nombre de liaison hydrogène est directement corrélé avec l'état de l'eau: 0 à l'état gazeux, 3.4 -en moyenne- à l'état liquide, 4 (le maximum) à l'état solide.L'orientation des liaisons entre atomes de carbones (tétravalents) et d'azotes (divalents)
Ces deux facteurs entraînent l'apparition de motif de repliement caractéristique de la structure secondaire. Il faut noter qu'une protéine peut comporter de très nombreux motif de repliements différents :
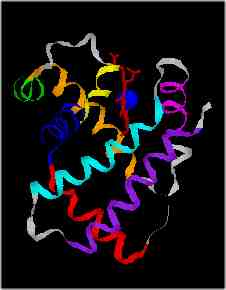
L'hélice alpha : Les acides aminés se replient de manière hélicoïdale. Certains acides aminés favorisent la mise en place de tel structures alors que d'autres l'inhibent car trop volumineux. Les acides aminés qui traversent les membranes dans les protéines membranaires (comme les canaux ioniques) sont très souvent repliés sous forme d'hélice alpha.
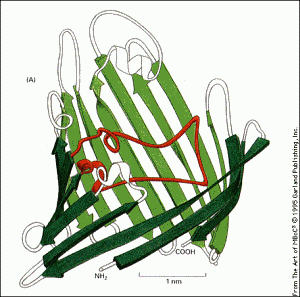
Feuillet béta : Ce motif de repliement est retrouvé dans des protéines fibreuses de structures, comme la kératine qui compose les ongles. Il s'agit d'un repliement semblable aux feuilles d'un listing d'une vieille imprimante, partiellement déroulé.
La structure tertiaire et quaternaire sont des niveaux plus complexes de repliements.
La structure tertiaire
C'est un nouveau repliement de la protéine, du aux interactions entre acides aminés éloignés dans la structure primaire : ces acides aminés seront donc par la fait d'un repliement 3D proche dans la structure tertiaire.
La structure quaternaire
L'association de plusieurs protéines synthétisés de manière indépendante et déjà replié en structure tertiaire représente la structure quaternaire de la protéine. Cet ultime degrés de repliement n'est pas retrouvé chez toutes les protéines. Cependant les protéines (ou plutôt complexes de protéines) qui doivent se replier en quaternaire nécessitent ce repliement pour être fonctionnelle.
Les structures tertiaire et quaternaire sont maintenus par des liaisons physico-chimique faible (Liaison hydrogène, Liaison de Van der Walls), plus rarement forte (pont disulfure).
La cellule contrôle étroitement le repliement des protéines dans la cellule, et ceci par deux grands mécanismes :
- Par des protéines dites " chaperonnes " :
Ce sont des protéines qui sont spécialisés dans le contrôle de bon repliement des autres protéines. Elles sont indispensables à la survie cellulaire car à la base du bon déroulement de la synthèse protéique. Les mutations de ces protéines sont très graves et presque toujours incompatible avec la vie.
Cette famille de protéine est appelée HSP suivi d'un numéro indiquant le poids moléculaire de la protéine. Ex : Hsp70 est une sous-famille de protéine chaperonne de poids moléculaire 70.
- Par des enzymes spécialisés:
Comme la PDI (protéine disulfide isomérase) qui accélère le repliement des protéines. Il faut noter que les enzymes sont elles mêmes de protéines.
La mauvaise conformation d'une protéine est immédiatement reconnu par la cellule qui procède à sa destruction par hydrolyse grâce à un complexe protéique appelé protéasome avec l'aide d'une HSP.
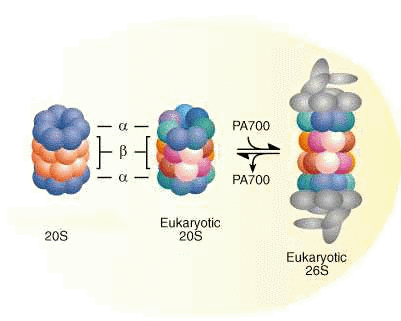
Définition: Les protéasomes
Il s'agit d'un complexe de plusieurs protéines chargés de détruire les protéines trop vieilles ou mal pliées dans la cellule. Il s'agit donc d'un petit tonneau dans le cytosol de la cellule qui hydrolisera ces protéines à PH neutre en consommant de l'ATP.
On distingue deux grands types de protéines, selon si elles sont constitués uniquement d'acides aminés ou d'acides aminés + un autre composants.
Les holoprotéines : elles ne sont constitués que par des acides aminés
On les classe selon leur morphologie :
- Globulaire : Albumine
- Fibrillaire : Kératine
Les hétéroprotéines : elles sont constitués d'acides aminés et d'un autre composé (liste non exhaustive)
- Glycoprotéines : AA + sucre
- Lipoprotéines : AA + lipide
- Chromoprotéines : AA + pigment, comme le fer dans la cas de l'hémoglobine
- Nucléoprotéines : AA + acides nucléiques